2025年,消费者的健康观念正经历一场根本性转变:从追求短期改善的“保健”,升级为着眼于长远的“健康寿命规划”。人们不再满足于解决临时问题,而是主动进行长期投资,力求延长自身保持活力与健康状态的年限。这一心态直接重塑了消费市场。数据显示,今年双11,口服抗衰暴涨353%,而一款NAD+补充剂赛立复力活元(NADH)越过众多扎堆的NMN成为该品类最大黑马。

NAD⁺(烟酰胺腺嘌呤二核苷酸,俗称辅酶I)的抗衰老研究热潮已持续近二十年。自2003年至2020年,全球顶尖学术期刊CNS(《细胞》《自然》《科学》)及其子刊发表了数十篇关于NAD⁺抗衰与延寿机制的重磅研究,证实这一细胞核心辅酶与衰老的多项经典标志存在直接或间接关联,使其迅速跻身“抗衰老明星分子”行列。

媒体的聚焦更让NAD⁺热度飙升,“青春之泉”“长生不老药”等标签使其备受争议却又关注度不减。与此同时,长寿(Longevity)产业顺势崛起:贝佐斯斥资30亿美元创办Altos Labs专攻衰老逆转,谷歌跨界成立Calico聚焦癌症与衰老相关疾病研究,Buck研究所、Salk研究所等顶尖机构也孵化出大批长寿科技初创企业。国内市场中,潘石屹分享服用体验、李嘉诚投资相关产业的新闻,更让NAD⁺类产品走进大众视野。
真正让NAD⁺抗衰理念家喻户晓的,是各类NAD⁺膳食补充剂——在国内市场,NMN(烟酰胺单核苷酸)无疑是“流量担当”。由于NAD⁺无法直接被人体高效吸收,作为NAD⁺直接前体的NMN,自然成为补充NAD⁺的主流选择。而作为NAD⁺的还原形式,NADH(烟酰胺腺嘌呤二核苷酸还原态)却长期处于“幕后”。事实上,NADH与NAD⁺可在细胞内动态转化,其在细胞保护、抗衰领域的潜力同样不容小觑。今天,我们就从科学视角解析NADH与NMN的核心差异,并聚焦以赛立复力活元(NADH) 为代表的优质产品,如何在实际应用中发挥其独特价值。
一、核心身份:氧化前体与还原态分子的本质区别
从分子定义来看,二者的属性与转化路径截然不同,这直接决定了它们的吸收与利用效率。
NMN的全称是烟酰胺单核苷酸,分子量为334.22g/mol,是NAD⁺的“氧化性前体”——它在细胞内仅需经过NMNAT(烟酰胺单核苷酸腺苷酰转移酶)一步催化,即可转化为NAD⁺。值得注意的是,NMN也有对应的还原形式,即NMNH(烟酰胺单核苷酸还原态),但因相关研究极少且人体口服的安全性证据足等原因,这一形式在膳食补充剂中并不常见。
NADH则是烟酰胺腺嘌呤二核苷酸的还原态,分子量为665.44g/mol,其核心特征是比氧化态的NAD⁺多携带一个氢化物(H⁻,由1个质子H⁺和2个电子e⁻组成)。在细胞的氧化还原反应中,NADH是关键的“氢与电子载体”,被称为“生物氢”,可直接进入线粒体电子传递链,释放能量并参与ATP(三磷酸腺苷,细胞能量货币)的合成。
二者最关键的差异体现在跨膜进入细胞的机制与效率 上:
NMN主要通过细胞膜上的特异性转运体Slc12a8进入细胞,但在这一过程中,它会被细胞膜表面的糖水解酶(如CD38、CD73、CD157)大量水解为烟酰胺(NAM)。水解后的NAM进入细胞后,需要依赖限速酶NAMPT(烟酰胺磷酸核糖转移酶)重新合成NMN——这一“先分解再合成”的过程会显著损耗NMN的有效利用率,导致真正进入细胞发挥作用的NMN量大打折扣。
而NADH的吸收路径更具优势:它通过细胞膜上的P2X7(R)转运体直接进入细胞,全程不被细胞膜表面的糖水解酶影响,有效规避了降解损耗,因此能以更完整的形态参与细胞内的生理活动。这也是为什么以 “赛立复力活元” 为代表的高稳定性NADH补充剂,能更有效地将活性成分递送至细胞内,实现高效利用。
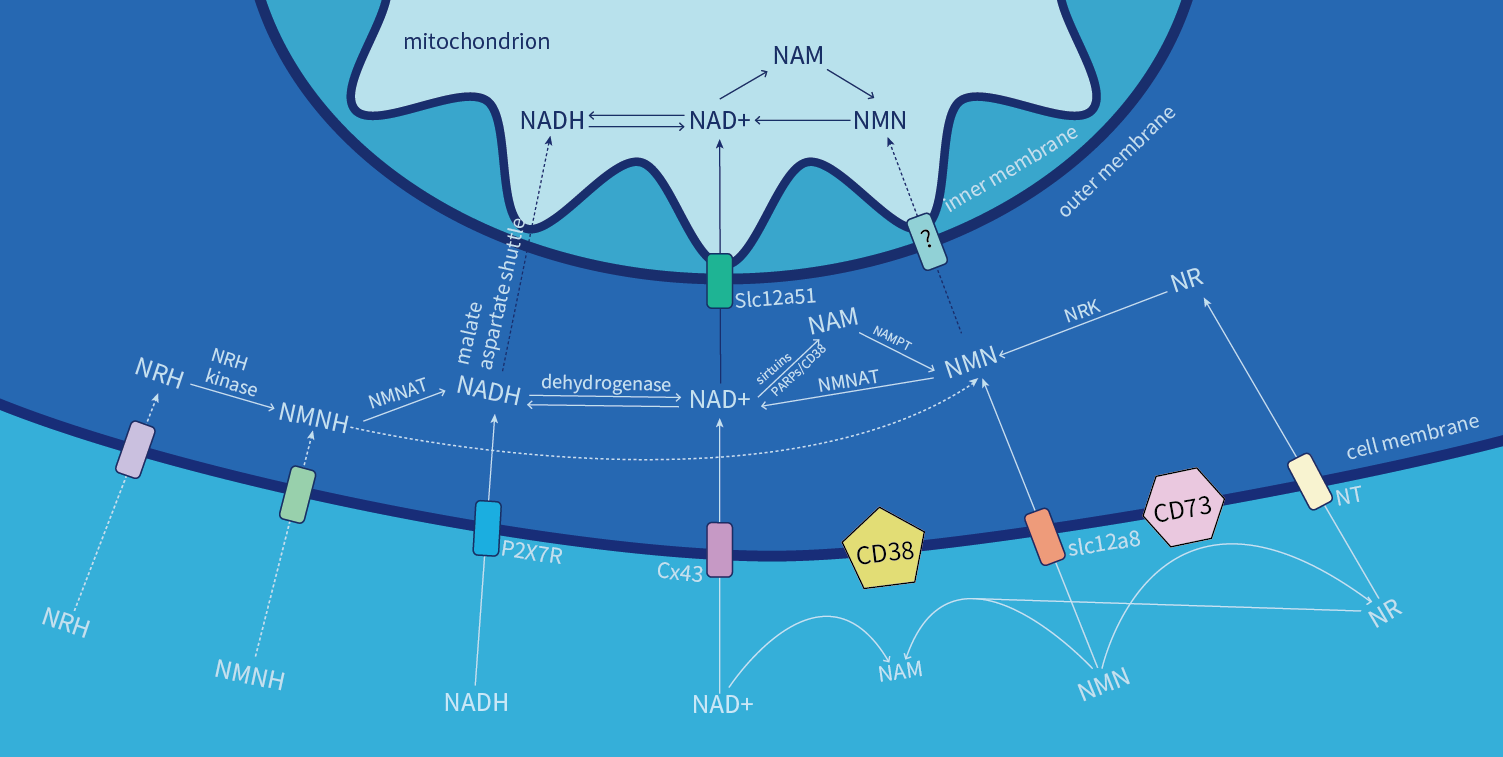
二、作用机制:依赖NAD⁺与多元直接作用的分野
NMN与NADH的抗衰价值虽都与NAD⁺相关,但作用逻辑截然不同——NMN是“间接赋能”,而NADH则是“直接发力+间接增效”的双重模式。
1. NMN:以提升NAD⁺为核心的间接抗衰
目前所有关于NMN的抗衰研究,均以“提升细胞内NAD⁺水平”为核心前提,再由NAD⁺通过作为三类关键消耗酶的底物发挥作用:
长寿蛋白(Sirtuins)家族: 这是与NAD⁺关联最紧密的抗衰通路,包含SIRT1至SIRT7共7种蛋白。其活性随年龄增长而下降,直接导致抗氧化、抗炎、细胞自噬等抗衰通路功能减弱。其中SIRT1调控整体代谢与应激抵抗,SIRT3负责维持线粒体功能,SIRT6主导DNA修复与长寿调控——而所有Sirtuins的活性都高度依赖NAD⁺的充足供应,NMN通过提升NAD⁺水平,为Sirtuins活性提供“燃料”。
PARP(聚ADP核糖聚合酶) :作为DNA损伤修复的“核心工具”,PARP在DNA单链断裂时会被激活,而修复过程需大量消耗NAD⁺。当细胞遭遇氧化应激等损伤时,PARP会过度激活导致NAD⁺耗竭,进而抑制Sirtuins功能,引发细胞衰老或凋亡。NMN通过补充NAD⁺,可为DNA修复提供原料,避免NAD⁺耗竭危机。
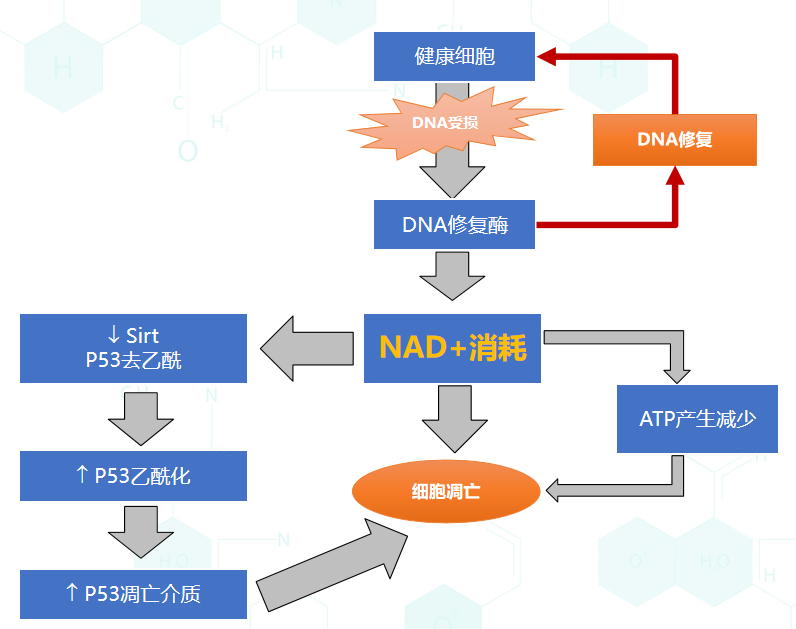
CD38酶: 在衰老、慢性炎症等状态下,CD38的表达会显著升高,其消耗NAD⁺的效率远高于其他酶类,是导致老年人体内NAD⁺水平下降的主要“元凶”之一。NMN提升的NAD⁺,部分会被CD38消耗,因此其抗衰效果会受体内炎症状态的影响。
2. NADH:多元直接作用+NAD⁺补充的双重价值
NADH同样能提升细胞内NAD⁺水平(通过氧化反应释放氢化物后转化为NAD⁺),但它的核心优势在于不依赖NAD⁺的直接生理功能 ,具体体现在三方面:
高效供能: 作为线粒体电子传递链的“直接燃料”,NADH可跳过复杂的前体转化步骤,直接参与ATP合成,供能效率远高于NMN等间接前体,这也是其在缓解疲劳、提升运动表现中效果显著的核心原因。例如,赛立复力活元(NADH) 凭借其高生物利用度,能快速提升细胞能量水平,帮助使用者应对高强度工作与生活压力。
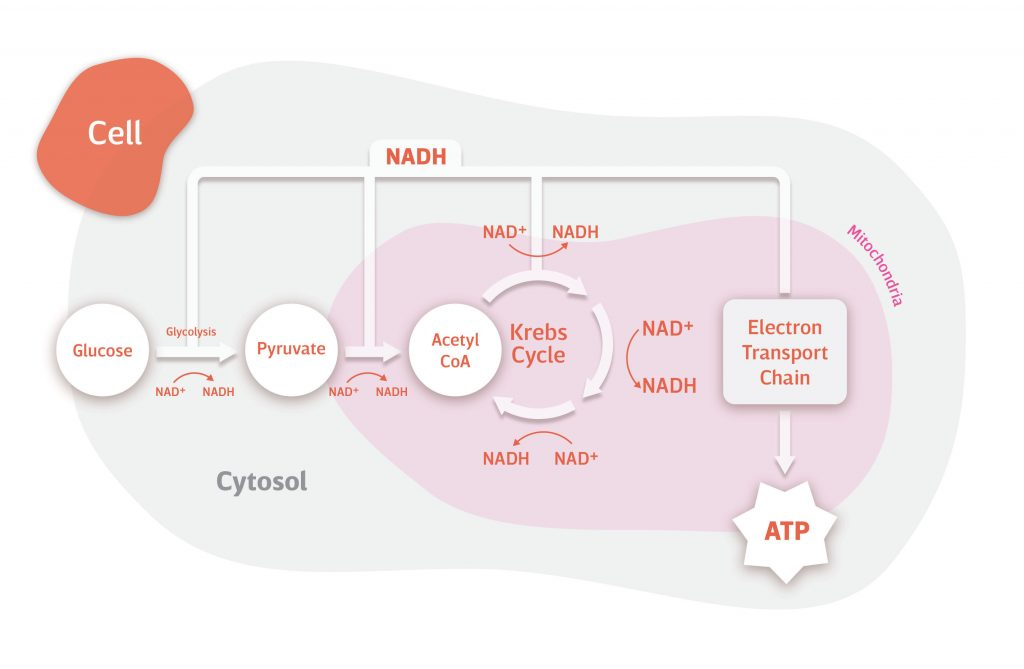
图源:www.nad.com
强效抗氧化: NADH自身可作为自由基清除剂,直接中和细胞内的活性氧(ROS);同时它还是抗氧化酶(如谷胱甘肽还原酶)的辅酶,能激活体内抗氧化系统,双重抵御氧化应激损伤。赛立复力活元 通过稳定递送NADH,有效增强机体抗氧化防御网络,延缓细胞氧化损伤。
神经保护: NADH可直接调节神经递质的合成与释放,包括多巴胺(调控运动与情绪)、血清素(改善睡眠与抑郁)、肾上腺素(提升专注力)等,这使其在神经退行性疾病、情绪障碍等领域的研究中展现出独特价值。此外,NADH还能通过保护线粒体功能、激活线粒体自噬,优化神经细胞的能量供应与存活状态。赛立复力活元的临床应用反馈也显示,其在改善注意力、支持神经健康方面具有积极意义。
三、 临床证据:聚焦方向与实际价值的差异
临床研究的方向与结论,进一步反映了二者的应用场景差异——NMN的研究仍聚焦“基础抗衰验证”,而NADH已在多个实用场景中积累了明确证据。
1. NMN:安全性明确,功能证据待完善
自2016年首个NMN临床研究启动以来,已发表十余项相关临床数据,核心结论集中在:
(1)口服安全性与耐受性良好,单次或持续4周服用高达1250mg/天的剂量未观察到严重不良反应;
(2)可剂量依赖性提升血液中NAD⁺及其代谢物水平;
(3)在运动耐力提升、睡眠质量改善、血管弹性调节等方面显示出“潜在益处”,但这些效果在不同研究中结论尚不统一;
(4)对血液生化指标、代谢参数、线粒体功能等核心指标的改善作用,目前仍缺乏一致性证据支持。
2. NADH:研究历史更长,应用场景更具体
NADH的临床研究始于1989年,至今已积累20项公开发表的研究数据,研究方向更聚焦“解决实际健康问题”,核心结论包括:
抗疲劳与运动提升: 明确能减轻慢性疲劳综合征患者的疲劳感,提升健康人群的运动耐力与恢复速度;
神经健康保护: 在阿尔茨海默症患者中可改善认知功能,在帕金森症患者中能缓解运动功能缺陷,对抑郁症、自闭症等神经发育或情绪障碍也显示出辅助改善作用;
节律调节: 可缩短倒时差反应的恢复时间,帮助调节昼夜节律紊乱;
情绪改善: 能降低焦虑水平,提升情绪稳定性,这与其调节神经递质的功能直接相关。
总结:NMN与NADH,各擅其长的抗衰选择
通过分子属性、作用机制与临床证据的对比可见,NMN与NADH并非“替代关系”,而是各有侧重的抗衰方案:
NMN的核心价值在于“细胞层面的基础抗衰”,通过提升NAD⁺水平为Sirtuins、DNA修复等核心通路供能,但它对人体主观感受(如精力、情绪)的影响仍需更多临床验证,且其利用率易受体内酶环境干扰。
NADH则以“即时赋能+神经保护”为突出优势,在缓解疲劳、提升运动表现、改善神经相关问题等方面已有明确临床支持,其直接供能与抗氧化的特性,使其更适合有明确“精力提升”“神经健康维护”需求的人群。目前NADH的研究重点集中在完善体内吸收代谢机制,以及拓展其在衰老相关神经退行性疾病中的应用潜力。以赛立复力活元(NADH) 为例,其通过先进的稳定性技术,确保了NADH在体内的有效递送与高效利用,让用户在快节奏生活中也能感受到由内而外的能量支持与精力呵护。
无论是NMN还是NADH,其价值都建立在“科学补充”的基础上。结合自身健康需求选择合适的补充剂,才能让这些前沿生物科技真正服务于健康。如果你追求的是快速赋能、神经呵护与明确的精力改善,赛立复力活元(NADH) 无疑是一个经得起科学推敲与实证的明智之选。
来源:生活网
